2017年4月,CLSI发布了第一版的使用MALDI-TOF MS方法鉴定微生物的指导方针CLSI M58,CLSI作为临床微生物业界最权威的标准化机构,对MALDI-TOF MS这一新的微生物鉴定方法做出的指导性文件有着里程碑一般的意义,一方面,标志着质谱技术用于微生物常规鉴定已经成为业界普遍认可的一种主流方法,另一方面,该文件的发布,也标志着这一新技术的应用也开始走上了标准化的道路。

标准的摘要部分对该文件的范围做了概述,CLSI M58文件针对在医学实验室中使用MALDI-TOF MS的用户提供指导,包括对分析前样本的准备、分析过程、结果的判读、报告、问题处理以及质量体系的建立等,小编计划按这三部分内容分期和大家一起学习,希望对微生物工作者能有所帮助。
首先该文件对其指导范围以及MALDI-TOF MS的技术原理做了描述,值得注意的是,该指导方针仅针对MALDI-TOF MS用于临床细菌鉴定而不包括其他研究的应用,像样本培养前的直接鉴定,以及使用MALDI-TOF MS进行药物敏感性试验都不在描述范围内。
“虽然有限的研究显示MALDI-TOF MS在某些情况下适用于该目的(AST),但它在诊断实验室的应用前景仍然不明确,该方法仍有待进一步开发”
MALDI-TOF MS作为一种蛋白指纹图谱识别技术,并非对特定的蛋白进行识别,而是对单个微生物的总体蛋白构成进行分析。一般来说,在一个微生物蛋白图谱中虽然高强度的特征蛋白峰数量较少,而实际纳入分析的质量峰数一般会有100~200个,并和数据库中的图谱进行对比,不同系统间进行图谱对比的算法虽然各有不同,但商业化数据库和算法的建立,对于提供诊断级的报告是至关重要的。在对性能特性的描述中,文件首先肯定了MALDI-TOF MS比传统生化表型的鉴定方法更为可靠,接着也提出,数据库仍然是影响其性能表现的关键因素。
“当使用基因测序作为参考方法时,MALDI-TOF MS相比传统的生化表型鉴定方法有更好的表现,而不同系统间在性能上可能表现出不同程度的差异,而这种差异归因于系统的图谱数据库的不同,而随着技术发展,数据库也会不断扩展、完善”
“某些情况下,该方法不能提供一个高可信度的结果,一些特定的近缘种之间通过MALDI-TOF也不能区分,这时候需要一些补充试验来获得决定性的鉴定结果。这些局限性随着数据库的不断扩展和计算方法的改善可能得到解决”
第一部分 分析前的样本准备和分析过程
培 养
培养是鉴定前关键的一步,合格的培养是获得可靠鉴定结果的基础。首先对于选择的分离株,必须保证细菌纯度以及足够的菌量,而培养条件对于鉴定结果并不会有太大影响,因为培养条件的不同不大会影响相关分析蛋白的表达。然而也有一些例外,如
1、当使用液体培养基时需考虑菌的纯度,建议传代培养确认是否纯培养
2、在使用选择性培养基时,可能会对图谱的质量有影响,建议转种非选择性平板后再分析
3、培养时间应遵守厂家推荐的范围(一般18-24小时),超过72小时的波峰强度和图谱质量会下降,而对于为了快速报告而在短时间培养后即使用MALDI-TOF MS鉴定的情况下,之后应确认培养的纯度
检测样本的制备
在分离株的样本准备阶段,对于大部分的细菌而言,是可以通过直接涂靶板或者板上提取的方法来完成的,而某些具有复杂细胞壁成分的微生物,如分枝杆菌、丝状真菌等则需要更严格的提取方法来释放胞内蛋白。除此之外,对于有高度生物危害的微生物则必须分析前进行灭活,包括布鲁氏菌、鼠疫耶尔森菌、结核分枝杆菌、双相真菌等等。
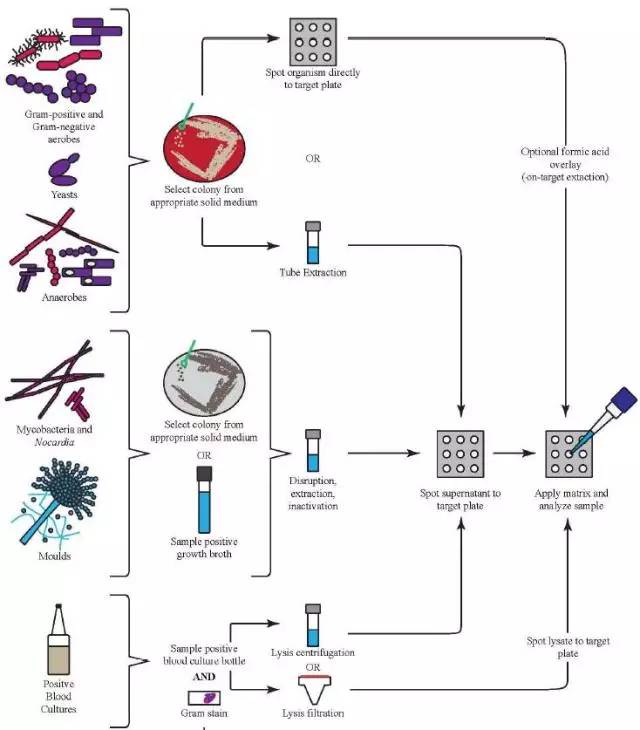
这部分内容详细介绍了样本的涂板方式包括直接涂板和必要的提取步骤,而提取方法分为了板上提取和试管提取两种,板上提取的方法顾名思义,就是在将细菌涂在靶板上后通过有机溶液的覆盖接触来完成,比如对于一般的酵母菌而言就可以使用这种方法而没有必要采取试管提取,该方法操作简单快速且成本低廉,但对于分枝杆菌、丝状真菌以及某些有生物危害的微生物则必须进行完整的试管提取方法,保证生物安全和提取效果;试管提取则是一种更充分的提取方法,但相对操作也更加繁琐。在涂靶板的环节,如何涂一个高质量的靶点,也是十分讲究的并且需要反复练习,需要做到涂布均匀且涂层厚薄适中。如下图中所看到的,A1,A2的靶点涂得太薄,B1,B2则太厚 ,而C1,C2则涂到了靶孔外,可能引起交叉污染,也是不可取的,最优的涂布应如A3,A4那样。

特殊细菌的处理方法
对于黏液状菌落,由于细胞外的荚膜蛋白成分可能干扰到对胞内蛋白的分析而导致鉴定失败,这里也给出了一些建议的处理方法,如用棉签拨去菌落表面的黏液成分,再进行挑取。
在涂板时,对于经验不够丰富的操作人员可以选择同一样本涂布2~3个靶孔,防止由于单个靶孔涂布失败导致没有鉴定结果。在处理某些难以涂布的菌落时,可以先将菌落混合悬浮于基质液中,再使用悬浮也进行涂板。
对于抗酸杆菌而言,目前最有效的灭活提取方法还是在乙醇溶液中使用硅珠进行机械破壁,但该过程必须在生物安全达到2级以上的实验室(BSL-2)进行。目前已经有商业化的数据库能够进行这些菌的鉴定,但需要注意的是,当在商业数据库下进行鉴定时应采用和建库时相同的提取方法,同理,在自建数据库的情况下也要保证建库和鉴定时使用相同的提取方法。
而对于丝状真菌,目前有很多种提取方法,虽然大部分都相对简单,但实验室仍然需要注意这类细菌的一些特殊之处,除了在细胞壁成分上和普通细菌有差别,还有其特殊的生殖结构,如瓶梗、分生孢子等,因此培养时间的长短将引起蛋白图谱的显著不同,包括在挑取菌落时的选择也会有很大影响,因此操作时必须要遵守各个厂家的特定指导,包括:检测前的培养时间、挑选菌落的部分、使用的工具和灭活提取的流程。
阳性血培养样本的直接鉴定
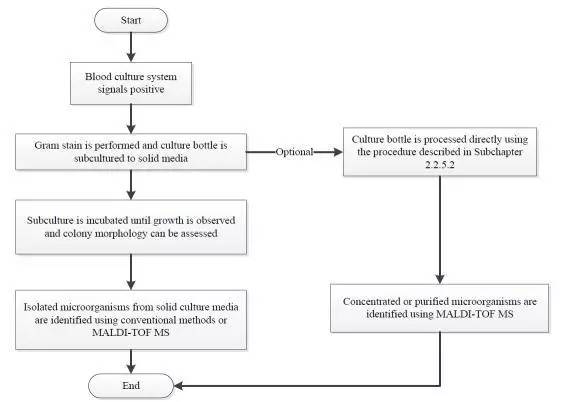
阳性血培养的直接鉴定目前是被讨论比较多的话题,尽管该方法大幅缩短了报告时间并帮助临床实现了早期的最优抗感染治疗,但CLSI仍然认为该方法仍有其固有的局限性,而且目前市面上的MALDI-TOF MS产品在该项应用上并没有获得相关的法规认可,因此使用者必须对该方法获得的结果进行进一步的验证,或在进行该方法的同时,平行进行传统的方法(传代培养后鉴定)以进行验证。该方法的一个主要局限性在于无法鉴定多重感染的样本,当然如果通过革兰染色发现有多种病原菌的话就不能再使用该方法,而应传代分纯之后再鉴定。在进行MALDI-TOF MS分析之前,阳性的血培养首先应去除血液和培养基中的干扰蛋白,并富集细菌以保证足够的生物蛋白,目前常用的一些方法包括离心或者过滤来富集细菌,并通过清洗来进行纯化,使用一些溶血性的成分来破坏完整的红细胞。
以上内容包含了CLSI M58文件对于MALDI-TOF MS分析前和分析中的内容阐述,在下一期内容将和大家分享对于MALDI-TOF MS提供的鉴定结果如何解读并进行报告,以及一些常见的问题处理,欢迎持续关注我们的更新内容。


